Газовые законы (страница 2)

На рисунке изображён график изменения состояния идеального газа в количестве 9 моль. Какое давление соответствует состоянию 1? Ответ дайте в кПа.

Так как прямая 1–2 в осях \(p/T\) проходит через начало координат, то на рисунке изображена изохора \((V=const)\). По закону Шарля: \[\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\hspace{3 mm}\Rightarrow \hspace{3 mm} p_1=\dfrac{T_1 \cdot p_2}{T_2}\] \[p_1=\dfrac{270 \text{ К} \cdot 4 \cdot 10^{4} \text{ Па}}{180 \text{ К}} = 6 \cdot 10^{4} \text{ Па} = 60 \text{ кПа}\]
Идеальный газ находится в цилиндре под поршнем, при этом давление газа составляет 180 кПа. После того, как поршень подняли вверх, объём газа увеличился в 2,4 раза. Найдите давление газа после поднятия поршня. Температура газа не меняется. Ответ дайте в кПа.
Так как процесс изотермический \((T=const)\), воспользуемся законом Бойля – Мариотта: \[p_1V_1 = p_2V_2\hspace{3 mm}\Rightarrow\hspace{3 mm} p_2 = \dfrac{p_1V_1}{V_2}\] С учетом того, что по условию \(V_2 = 2,4V_1\), найдем давление газа после поднятия поршня: \[p_2 = \dfrac{180 \cdot 10^{3} \text{ Па} \cdot V_1}{2,4V_1} = 75 \cdot 10^{3} \text{ Па} = 75 \text{ кПа}\]
В сосуде находится газ под давлением 150 кПа. Какое установилось давление в сосуде, после того как из него выпустили 2/3 газа? Температуру газа считать неизменной. Ответ дайте в кПа.
По условию процесс изотермический (\(T=const\)). Так как 2/3 газа выпустили, а объем не изменился, то концентрация газа уменьшилась в 3 раза. Давление же находится по формуле: \[p=nkT,\] где \(n\) – концентрация, \(k\) – постоянная Больцмана, \(T\) – температура. В нашем случае изменилась концентрация, а именно, уменьшилась в 3 раза, что означает, что и давление уменьшится в 3 раза, следовательно, конечное давление 50кПа
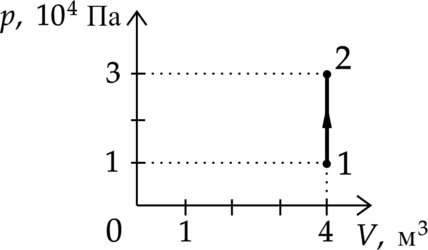
На рисунке изображено изменение состояния постоянной массы разреженного аргона. Температура газа в состоянии 1 равна 27 \(^\circ C\). Какая температура соответствует состоянию 2?
“Демоверсия 2017”
Переведем начальную температуру в Кельвины: \[T_1=27+273=300\text{ К}\] Объем постоянен, применим закон Шарля: \[\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\] Откуда температура во втором состоянии: \[T_2= T_1\dfrac{p_2}{p_1}=3T_1=900 \text{ К}\]
Температура идеального газа \(T = 273\) К. Какой станет температура, если при неизменном объёме увеличить давление в 3 раза?
“Досрочная волна 2019 вариант 1”
Если при неизменном объеме увеличить давление в 3 раза, то температура также возрастет в 3 раза и станет равной \(T_1=3T=819\)
Конечная температура газа в некотором процессе \(—- 373^{\circ}\)С. В ходе этого процесса объём идеального газа увеличился в 2 раза, а давление не изменилось. Какова была начальная абсолютная температура газа?
“Досрочная волна 2019 вариант 2”
Переведем температуру в Кельвины:
\(T=273+373=646\) К.
Так как объем увеличился в 2 раза, а давление не изменилось, то по закону Шарля тепмпература увеличилась тоже в 2 раза, значит, начальная температура будет равна: \[T_0=\dfrac{T}{2}=323\text{ К}\]


