.02 Термодинамика
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах , где
—
давление газа,
— абсолютная температура газа. Вещество газа взято в количестве 5 моль.
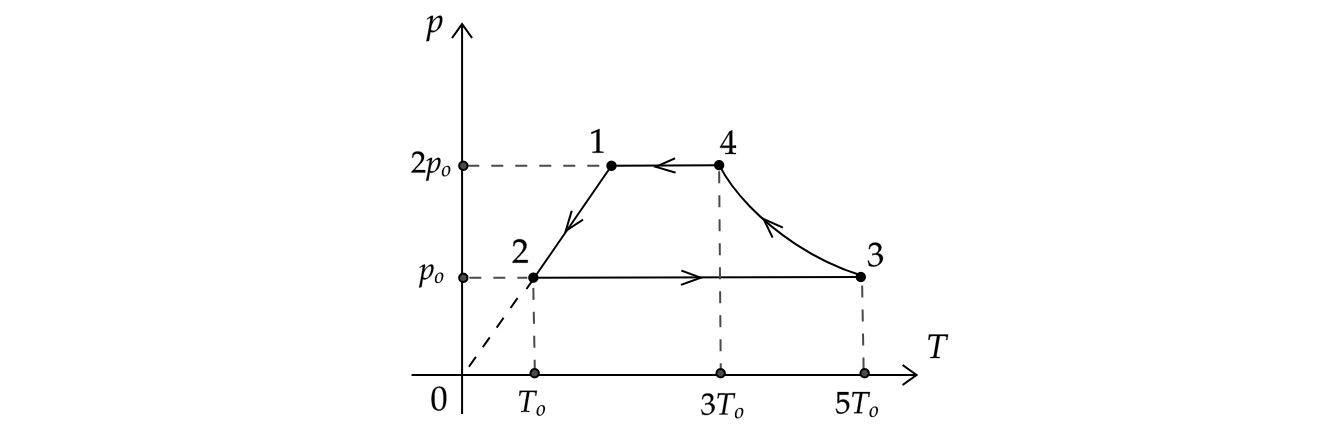
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Внутренняя энергия газа в состоянии 2 в три раза меньше, чем в состоянии 1.
2) Работа газа в процессе 2-3 в 4 раза больше, чем работа, совершенная внешними силами в процессе 4-1.
3) В процессе 3-4 внутренняя энергия газа не изменяется.
4) В процессе 2-3 системе было передано положительное количество теплоты.
5) В процессе 1-2 концентрация молекул газа уменьшилась вдвое.
1)
Внутренняя энергия газа в состоянии 1 и в состоянии 2 соответственно равна:
где — количество вещества газа,
— универсальная газовая постоянная.
Найдем отношение к
, учитывая, что
(по условию) и
:
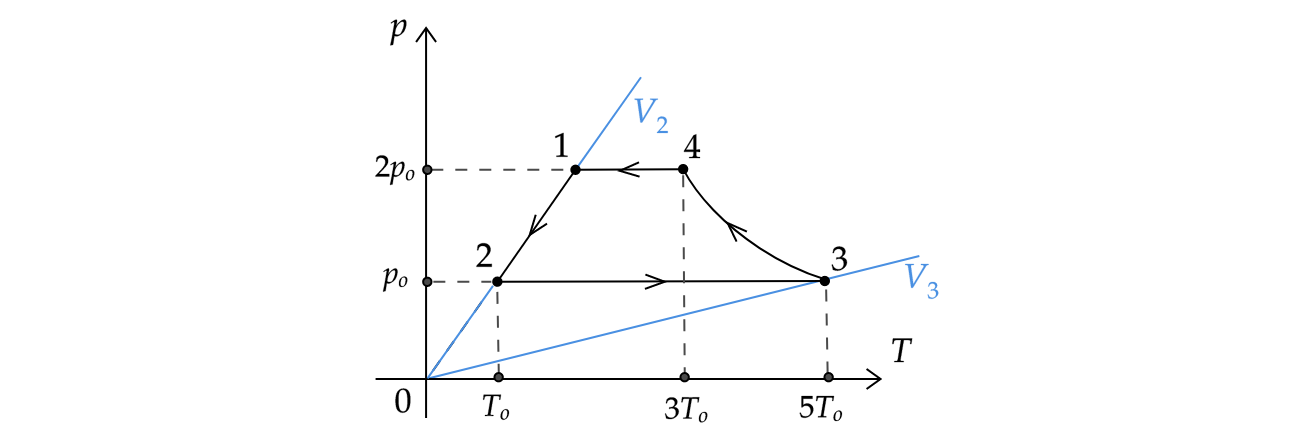
По графику видно, что процесс 1-2 – изохорный. По закону Шарля(*):
(*)То же самое можно вывести из уравнения Менделеева-Клапейрона.
Таким образом, внутренняя энергия газа в состоянии 2 в два раза меньше, чем в состоянии 1.
2)
Так как график дан не в p-V координатах, то искать по нему работу газа как площадь фигуры нельзя. Найдем работу газа в
процессе 2-3:
Мы можем заменить на
и
на
, исходя из уравнения Менделеева-Клапейрона.
Таким же образом найдем работу внешних сил в процессе 4-1:
Найдем отношение работы газа в процессе 2-3 и работы внешних сил в процессе 4-1:
3)
Изменение внутренней энергии газа зависит от изменения его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
Процесс 3-4 не является изотермическим. Следовательно, температура газа не постоянна и ее изменение не равно нулю, поэтому и
внутренняя энергия тоже не постоянна:
4)
Процесс 2-3 — изобарный (так как по графику видно, что ). Запишем первый закон термодинамики для изобарного
процесса:
Работа газа прямо пропорциональна изменению его объема:
Мысленно проведем изохоры и
. Так как изохора
лежит ”ниже” изохоры
, то изменение объема газа
положительно. Таким образом, газ в процессе 2-3 совершает положительную работу:
.
Изменение внутренней энергии газа зависит от изменения его температуры:
По рисунку видно, что . Значит, изменение температуры газа положительно:
. То есть изменение внутренней
энергии
также положительно.
Так как изменение внутренней энергии газа и его работа положительны, то и количество теплоты также
положительно.
5)
Зависимость давления газа от концентрации молекул и его абсолютной температуры выражается следующей формулой:
где — постоянная Больцмана. Далее можно рассуждать двумя способами.
1. Графически: по графику процесса 1-2 видно, что зависимость является линейной. Значит, в функции
изменяется только один параметр — температура
. Следовательно, концетрация молекул газа остается постоянной.
2. Аналитически: найдем отношение к
и убедимся, что в процессе 1-2 концентрация молекул газа не изменяется.
Специальные программы

Программа
лояльности v2.0
Приглашай друзей в Школково и получай вознаграждение до 10%!
Крути рулетку
и выигрывай призы!
Крути рулетку и покупай курсы со скидкой, которая привязывается к вашему аккаунту.

Бесплатное онлайн-обучение
Для школьников из приграничных территорий России, проживающих в ДНР, ЛНР, Херсонской, Запорожской, Белгородской, Курской, Брянской областях и Крыму.

Налоговые вычеты
Узнай, как получить налоговый вычет при оплате обучения в «Школково».
Специальное предложение
для учителей
Бесплатный доступ к любому курсу подготовки к ЕГЭ, ОГЭ и олимпиадам от «Школково». Мы с вами делаем общее и важное дело, а потому для нас очень значимо быть чем-то полезными для учителей по всей России!

Вернём деньги за курс
за твою сотку на ЕГЭ
Сдать экзамен на сотку и получить обратно деньги за подготовку теперь вполне реально!




