.02 Термодинамика
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах , где
—
давление газа,
— объем газа. Количество вещества газа остается неизменным.
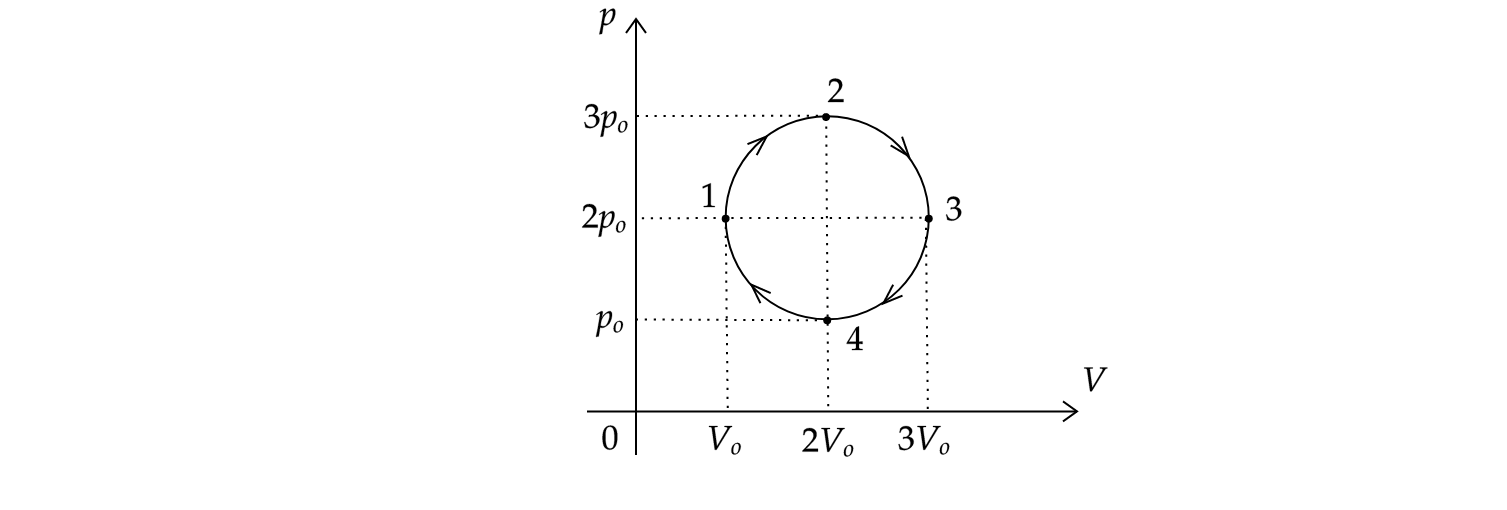
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Внутренние энергии газа в состоянии 1 и в состоянии 3 равны.
2) В процессе 3-4 системе было передано положительное количество теплоты.
3) В процессе 1-2 внешние силы совершили над газом отрицательную работу.
4) Работа, совершенная газом за цикл, равна нулю.
5) Газ в процессе 1-2 и в процессе 2-3 совершил одинаковые работы.
1)
Внутренняя энергия газа зависит от температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
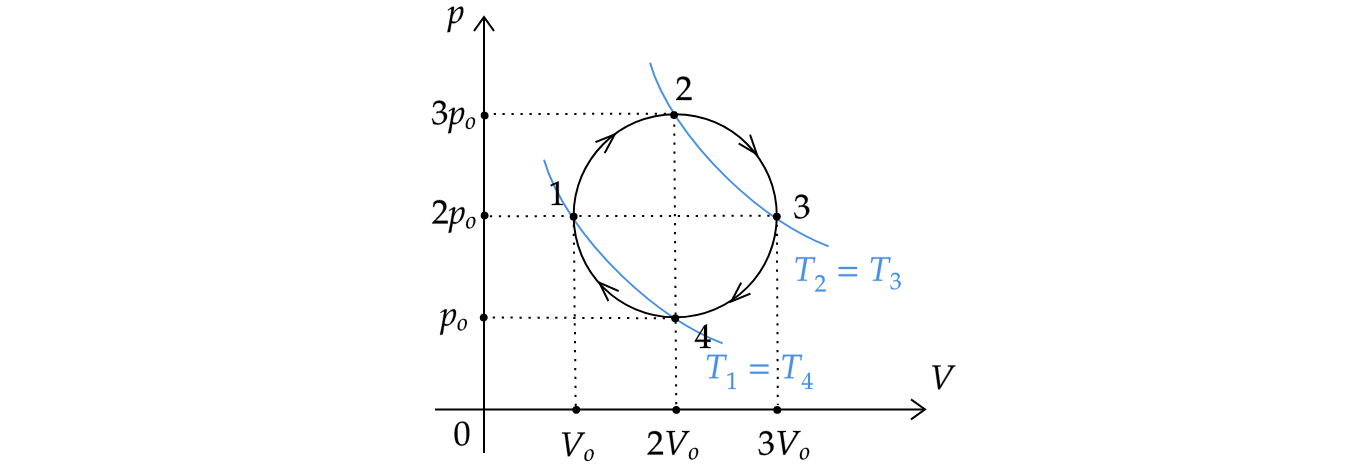
Мысленно проведем на графике две изотермы: и
. Так как изотерма
лежит ”ниже” изотермы
, то
.
Cледовательно, внутренняя энергия газа в состоянии 1 меньше, чем в состоянии 3.
2)
Запишем первый закон термодинамики для процесса 3-4:
Работа газа зависит от изменения его объема: .
По графику видно, что объем газа в процессе 3-4 уменьшается. Следовательно, газ совершил отрицательную работу.
Изменение внутренней энергии газа зависит от температуры:
Мысленно проведем на графике две изотермы: и
. Так как изотерма
лежит ”ниже” изотермы
, то
.
Cледовательно, изменение температуры отрицательно:
. Следовательно, и изменение внутренней энергии
также отрицательно.
Так как изменение внутренней энергии газа и его работа отрицательны, то и количество теплоты также
отрицательно.
3)
Работа внешних сил в процессе 1-2 равна:
По графику видно, что объем в процессе 1-2 увеличивается. Следовательно, газ совершил положительную работу. Следовательно, работа внешних сил отрицательна.
4)
Работа , совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1.
Работа, совершенная газом в процессе 1-2-3, положительна и равна площади под графиком, а работа, совершенная в процессе 3-4-1,
отрицательна и также равна площади под графиком.
Суммарная работа равна разности этих двух площадей и, следовательно, равна площади внутри замкнутой кривой, изображающей
цикл.
Так как объем газа увеличился, то газ за цикл совершил положительную работу.
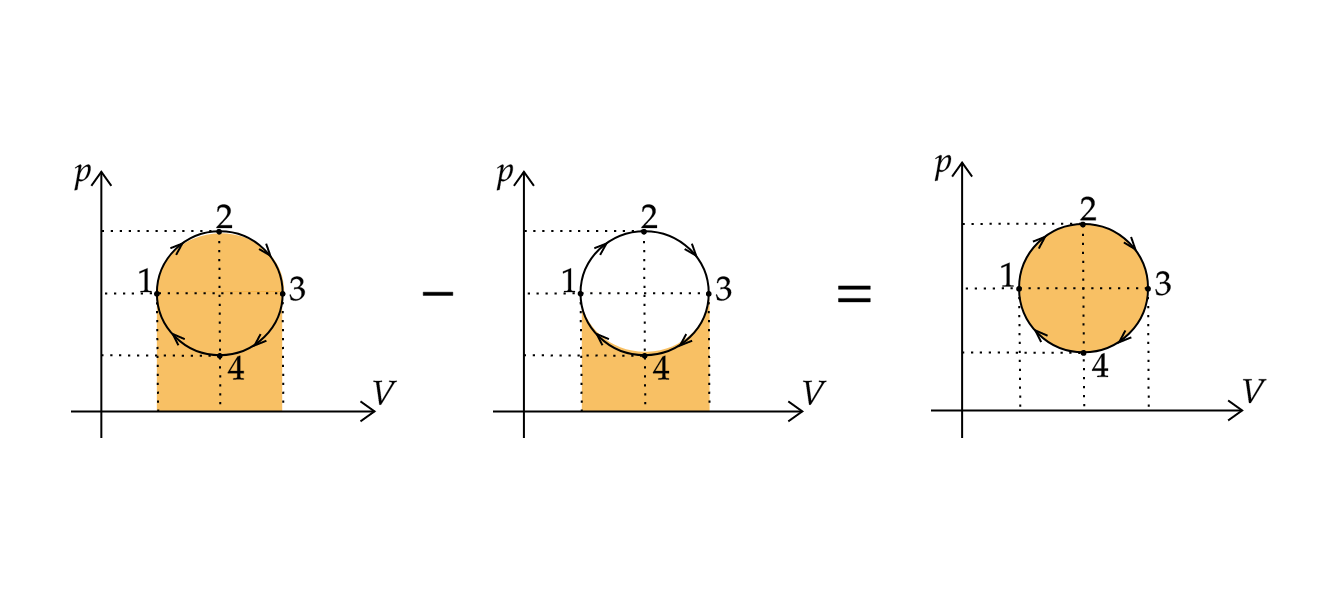
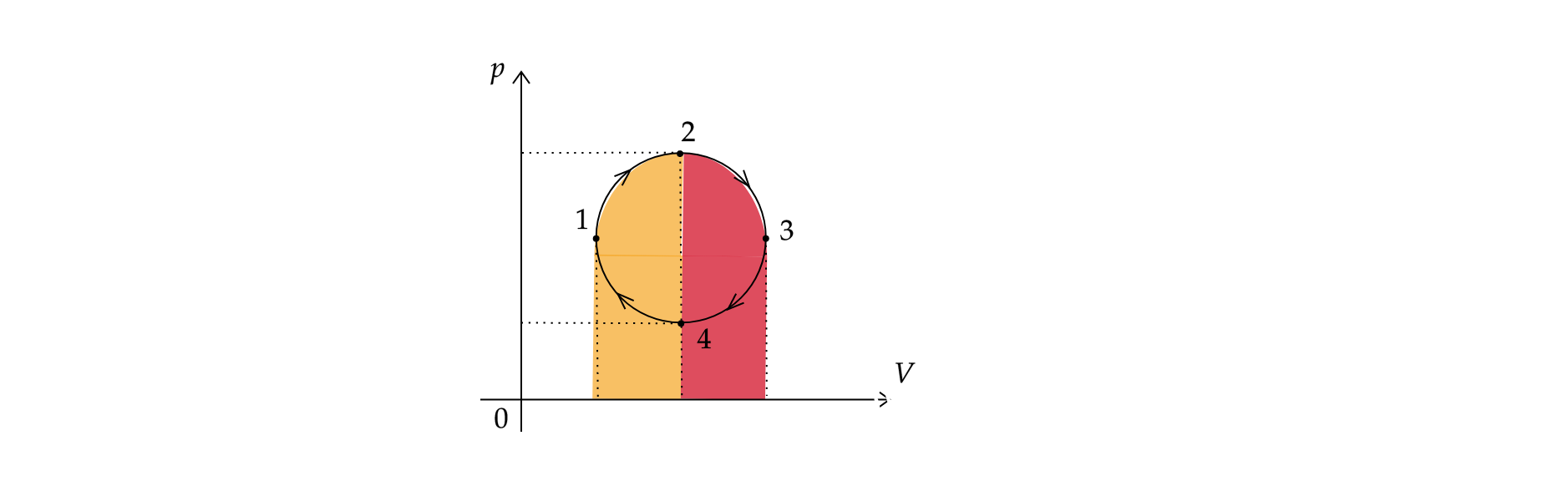
5)
Работы газа в процессах 1-2 и 2-3 можно найти как площадь под графиками этих процессов. По рисунку видно, что площади под
графиком 1-2 и 2-3 одинаковы. Следовательно, и работы газа, совершенные за эти процессы, также одинаковы.
Специальные программы

Программа
лояльности v2.0
Приглашай друзей в Школково и получай вознаграждение до 10%!
Крути рулетку
и выигрывай призы!
Крути рулетку и покупай курсы со скидкой, которая привязывается к вашему аккаунту.

Бесплатное онлайн-обучение
Для школьников из приграничных территорий России, проживающих в ДНР, ЛНР, Херсонской, Запорожской, Белгородской, Курской, Брянской областях и Крыму.

Налоговые вычеты
Узнай, как получить налоговый вычет при оплате обучения в «Школково».
Специальное предложение
для учителей
Бесплатный доступ к любому курсу подготовки к ЕГЭ, ОГЭ и олимпиадам от «Школково». Мы с вами делаем общее и важное дело, а потому для нас очень значимо быть чем-то полезными для учителей по всей России!

Вернём деньги за курс
за твою сотку на ЕГЭ
Сдать экзамен на сотку и получить обратно деньги за подготовку теперь вполне реально!




