Термодинамика

На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах \(p-V\), где \(p\) — давление газа, \(V\) — объем газа. Вещество газа взято в количестве 2 моль.
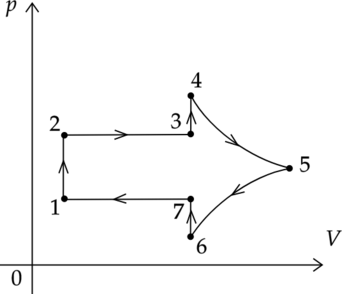
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) В процессе 5-6 внутренняя энергия газа постоянна.
2) В процессе 2-3 газ совершает положительную работу, причем его внутренняя энергия уменьшается.
3) Работа, совершенная в процессе 5-6 внешними силами меньше, чем работа, совершенная газом в процессе 4-5.
4) В процессе 7-1 газ получает положительное количество теплоты.
5) В процессе 6-7 работа внешних сил над газом равна нулю.
1) \(\color{red}{\small\text{Неверно }}\)
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U = \frac{3}{2}\nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Процесс 5-6 не является изотермическим. Следовательно, температура газа не постоянна и ее изменение не равно нулю, поэтому и внутренняя энергия тоже не постоянна: \[\Delta T \neq 0 \Rightarrow \Delta U \neq 0 \Rightarrow U \neq const\]
2) \(\color{red}{\small\text{Неверно }}\)
Работа газа прямо пропорциональна изменению его объема, и в процессе 2-3 она равна: \[A'_{2-3} = p_2\Delta V = p_2(V_3-V_2)\] Заметим, что \((V_3-V_2) > 0\). Следовательно, и изменение объема газа также больше нуля: \(\Delta V > 0\).
Следовательно, газ в процессе 2-3 совершает положительную работу: \(A'_{2-3} > 0\).
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U = \frac{3}{2}\nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
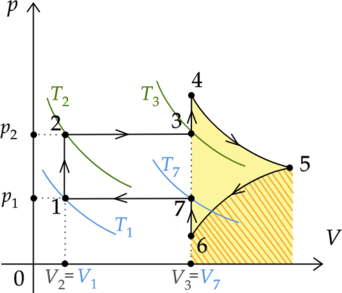
Мысленно проведем на графике две изотермы: \(T_2\) и \(T_3\). Так как изотерма \(T_3\) лежит ”выше” изотермы \(T_2\), то \(T_3 > T_2\). Значит, изменение температуры положительно: \(\Delta T = T_3 - T_2 > 0\). Следовательно, и изменение внутренней энергии \(\Delta U\) также положительно, поэтому внутренняя энергия газа в процессе 2-3 не уменьшается, а увеличивается.
3) \(\color{green}{\small\text{Верно }}\)
Так как график дан в p-V координатах, то работу газа можно найти, вычислив площадь фигуры под графиком процесса. По рисунку видно (сравним площади под графиком процесса 5-6 и процесса 4-5), что внешние силы в процессе 5-6 действительно совершили меньшую работу, чем совершил газ в процессе 4-5.
4) \(\color{red}{\small\text{Неверно }}\)
Процесс 7-1 — изобарный (т.к. \(p_7=p_1=const\)). Запишем первый закон термодинамики для изобарного процесса: \[Q_{7-1} = A'_{7-1} + \Delta U_{7-1}\] Работа газа прямо пропорциональна изменению его объема, и в процессе 7-1 она равна: \[A'_{7-1} = p_1\Delta V = p_1(V_1-V_7)\] Заметим, что \((V_1-V_7) < 0\). Следовательно, и изменение объема газа также меньше нуля: \(\Delta V < 0\). Следовательно, газ в процессе 7-1 совершает отрицательную работу: \(A'_{7-1} < 0\).
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U_{7-1} = \frac{3}{2}\nu R\Delta T\] Мысленно проведем на графике две изотермы: \(T_7\) и \(T_1\). Так как изотерма \(T_1\) лежит ”ниже” изотермы \(T_7\), то \(T_1 < T_7\). Cледовательно, изменение температуры отрицательно: \(\Delta T = T_1 - T_7 < 0\). Следовательно, и изменение внутренней энергии \(\Delta U_{7-1}\) также отрицательно.
Так как изменение внутренней энергии газа и его работа отрицательны, то и количество теплоты \(Q_{7-1}\) также отрицательно. Значит, газ не получает положительное количество теплоты, а отдает его.
5) \(\color{green}{\small\text{Верно }}\)
Работа внешних сил над газом в процессе 6-7 равна: \[A_{6-7} = - A'_{6-7},\] где \(A'_{6-7}\) — работа, совершенная газом, в процессе 6-7.
Работа газа зависит от изменения его объема. По графику видно, что объем газа в процессе 6-7 не изменяется, поэтому работа, совершаемая газом за этот процесс, равна нулю. Следовательно, и работа внешних сил над газом равна нулю.
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах \(p-T\), где \(p\) — давление газа, \(T\) — абсолютная температура газа. Вещество газа взято в количестве 5 моль.
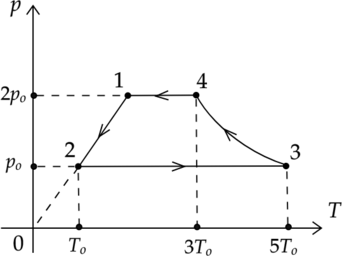
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Внутренняя энергия газа в состоянии 2 в три раза меньше, чем в состоянии 1.
2) Работа газа в процессе 2-3 в 4 раза больше, чем работа, совершенная внешними силами в процессе 4-1.
3) В процессе 3-4 внутренняя энергия газа не изменяется.
4) В процессе 2-3 системе было передано положительное количество теплоты.
5) В процессе 1-2 концентрация молекул газа уменьшилась вдвое.
1) \(\color{red}{\small\text{Неверно }}\)
Внутренняя энергия газа в состоянии 1 и в состоянии 2 соответственно равна: \[U_1 = \frac{3}{2}\nu RT_1\] \[U_2 = \frac{3}{2}\nu RT_2,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
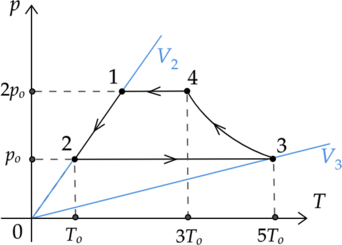
Найдем отношение \(U_2\) к \(U_1\), учитывая, что \(\nu = const\) (по условию) и \(R = const\): \[\displaystyle{\frac{U_2}{U_1} = \frac{\frac{3}{2}\nu RT_2}{\frac{3}{2}\nu RT_1}} \Rightarrow \frac{U_2}{U_1} = \frac{T_2}{T_1}\] По графику видно, что процесс 1-2 – изохорный. По закону Шарля(*): \[\frac{p_1}{T_1} = \frac{p_2}{T_2} \Rightarrow T_1 = \frac{p_1T_2}{p_2} \Rightarrow T_1 = \frac{2p_oT_2}{p_o} = 2T_2\] (*)То же самое можно вывести из уравнения Менделеева-Клапейрона. \[\frac{U_2}{U_1} = \frac{T_2}{2T_2} = \frac{1}{2}\] Таким образом, внутренняя энергия газа в состоянии 2 в два раза меньше, чем в состоянии 1.
2) \(\color{green}{\small\text{Верно }}\)
Так как график дан не в p-V координатах, то искать по нему работу газа как площадь фигуры нельзя. Найдем работу газа в процессе 2-3: \[A'_{2-3} = p_2(V_3-V_2) = p_2V_3 - p_2V_2 = \nu RT_3 - \nu RT_2 = \nu R(T_3 - T_2)\] \[A'_{2-3} = \nu R(5T_o - T_o) = 4\nu RT_o\] Мы можем заменить \(p_2V_3\) на \(\nu RT_3\) и \(p_2V_2\) на \(\nu RT_2\), исходя из уравнения Менделеева-Клапейрона.
Таким же образом найдем работу внешних сил в процессе 4-1: \[A_{4-1} = -A'_{4-1} = -p_1(V_1-V_4) = -(p_1V_1 - p_1V_4) = -(\nu RT_1 - \nu RT_4) = -(\nu R(T_1 - T_4))\] \[A_{4-1} = -(\nu R(2T_o - 3T_o)) = -(-\nu RT_o) = \nu RT_o\] Найдем отношение работы газа в процессе 2-3 и работы внешних сил в процессе 4-1: \[\displaystyle{\frac{A'_{2-3}}{A_{4-1}} = \frac{4\nu RT_o}{\nu RT_o}} = 4\]
3) \(\color{red}{\small\text{Неверно }}\)
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U = \frac{3}{2}\nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Процесс 3-4 не является изотермическим. Следовательно, температура газа не постоянна и ее изменение не равно нулю, поэтому и внутренняя энергия тоже не постоянна: \[\Delta T \neq 0 \Rightarrow \Delta U \neq 0 \Rightarrow U \neq const\]
4) \(\color{green}{\small\text{Верно }}\)
Процесс 2-3 — изобарный (так как по графику видно, что \(p = const\)). Запишем первый закон термодинамики для изобарного процесса: \[Q_{2-3} = A'_{2-3} + \Delta U_{2-3}\] Работа газа прямо пропорциональна изменению его объема: \[A'_{2-3} = p_2\Delta V\] Мысленно проведем изохоры \(V_2\) и \(V_3\). Так как изохора \(V_3\) лежит ”ниже” изохоры \(V_2\), то изменение объема газа положительно. Таким образом, газ в процессе 2-3 совершает положительную работу: \(A'_{2-3} > 0\).
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U_{2-3} = \frac{3}{2}\nu R\Delta T\] По рисунку видно, что \(T_3 > T_2\). Значит, изменение температуры газа положительно: \(T_3 - T_2 > 0\). То есть изменение внутренней энергии \(\Delta U_{2-3}\) также положительно.
Так как изменение внутренней энергии газа и его работа положительны, то и количество теплоты \(Q_{2-3}\) также положительно.
5) \(\color{red}{\small\text{Неверно }}\)
Зависимость давления газа от концентрации молекул и его абсолютной температуры выражается следующей формулой: \[p = nkT,\] где \(k\) — постоянная Больцмана. Далее можно рассуждать двумя способами.
1. Графически: по графику процесса 1-2 видно, что зависимость \(p(T)\) является линейной. Значит, в функции \(p(T) = nkT\) изменяется только один параметр — температура \(T\). Следовательно, концетрация молекул газа остается постоянной.
2. Аналитически: найдем отношение \(n_1\) к \(n_2\) и убедимся, что в процессе 1-2 концентрация молекул газа не изменяется. \[p_1 = n_1kT_1; \text{ } p_2 = n_2kT_2\] \[\frac{p_1}{p_2} = \frac{n_1kT_1}{n_2kT_2} \Rightarrow \frac{n_1}{n_2} = \frac{p_1kT_2}{p_2kT_1} = \frac{p_1T_2}{p_2T_1}\] \[\frac{n_1}{n_2} = \frac{2p_oT_o}{p_o2T_o} = 1\]
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах \(p-V\), где \(p\) — давление газа, \(V\) — объем газа. Количество вещества газа остается неизменным.
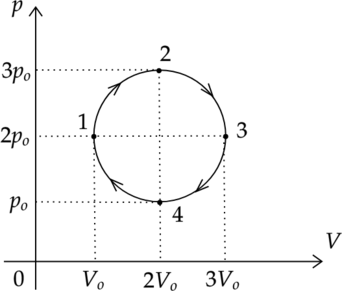
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Внутренние энергии газа в состоянии 1 и в состоянии 3 равны.
2) В процессе 3-4 системе было передано положительное количество теплоты.
3) В процессе 1-2 внешние силы совершили над газом отрицательную работу.
4) Работа, совершенная газом за цикл, равна нулю.
5) Газ в процессе 1-2 и в процессе 2-3 совершил одинаковые работы.
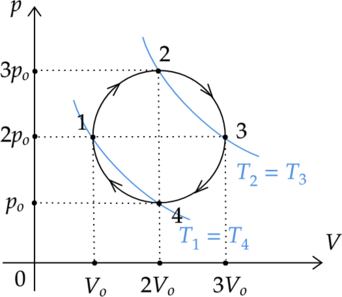
1) \(\color{red}{\small\text{Неверно }}\)
Внутренняя энергия газа зависит от температуры: \[U_1 = \nu RT_1\] \[U_3 = \nu RT_3,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Мысленно проведем на графике две изотермы: \(T_1\) и \(T_3\). Так как изотерма \(T_1\) лежит ”ниже” изотермы \(T_3\), то \(T_1 < T_3\). Cледовательно, внутренняя энергия газа в состоянии 1 меньше, чем в состоянии 3.
2) \(\color{red}{\small\text{Неверно }}\)
Запишем первый закон термодинамики для процесса 3-4: \[Q_{3-4} = A'_{3-4} + \Delta U_{3-4}\] Работа газа зависит от изменения его объема: \(A'_{3-4} = p \Delta V\).
По графику видно, что объем газа в процессе 3-4 уменьшается. Следовательно, газ совершил отрицательную работу.
Изменение внутренней энергии газа зависит от температуры: \[\Delta U = \frac{3}{2} \nu R\Delta T\] Мысленно проведем на графике две изотермы: \(T_3\) и \(T_4\). Так как изотерма \(T_4\) лежит ”ниже” изотермы \(T_3\), то \(T_4 < T_3\). Cледовательно, изменение температуры отрицательно: \(\Delta T = T_4 - T_3 < 0\). Следовательно, и изменение внутренней энергии \(\Delta U_{3-4}\) также отрицательно.
Так как изменение внутренней энергии газа и его работа отрицательны, то и количество теплоты \(Q_{3-4}\) также отрицательно.
3) \(\color{green}{\small\text{Верно }}\)
Работа внешних сил в процессе 1-2 равна: \[A_{1-2} = -A'_{1-2} = - p\Delta V\] По графику видно, что объем в процессе 1-2 увеличивается. Следовательно, газ совершил положительную работу. Следовательно, работа внешних сил отрицательна.
4) \(\color{red}{\small\text{Неверно }}\)
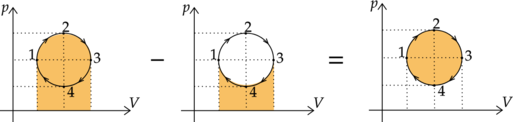
Работа \(A_\text{ц}\), совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1.
Работа, совершенная газом в процессе 1-2-3, положительна и равна площади под графиком, а работа, совершенная в процессе 3-4-1, отрицательна и также равна площади под графиком.
Суммарная работа равна разности этих двух площадей и, следовательно, равна площади внутри замкнутой кривой, изображающей цикл.
Так как объем газа увеличился, то газ за цикл совершил положительную работу.
5) \(\color{green}{\small\text{Верно }}\)
Работы газа в процессах 1-2 и 2-3 можно найти как площадь под графиками этих процессов. По рисунку видно, что площади под графиком 1-2 и 2-3 одинаковы. Следовательно, и работы газа, совершенные за эти процессы, также одинаковы. 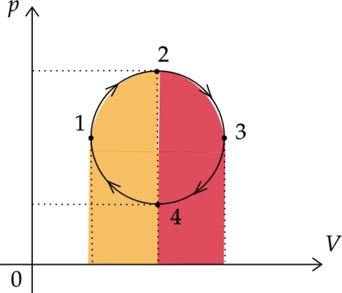
На \(Tp\)-диаграмме изображен процесс перехода одноатомного идеального газа из состояния 1 в состояние 4. Количество вещества газа постоянно.
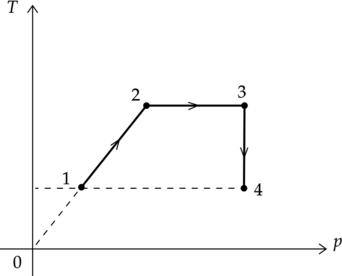
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) В процессе 2-3 системе сообщили положительное количество теплоты.
2) В процессе 3-4 работа газа равна нулю.
3) Внутренняя энергия газа в процессе 2-3 остается неизменной.
4) Внешние силы не совершили над газом работу в процессе 1-2.
5) Объем газа в состоянии 4 максимален.
Для более удобной работы перестроим график из координат \(T-p\) в координаты \(p-V\):
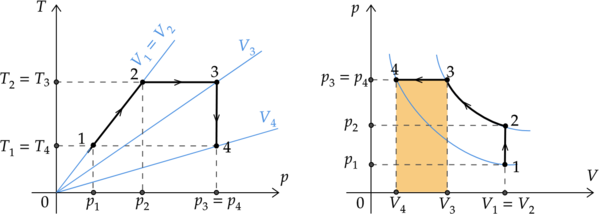
1) \(\color{red}{\small\text{Неверно }}\)
Процесс 2-3 изотермический. Запишем первый закон термодинамики для изотремического процесса: \[Q_{2-3} = A'_{2-3}\] Так как в процессе 2-3 объем газа уменьшается, то работа газа \(A'_{2-3}\) отрицательна. Значит, и количество теплоты, переданное системе, отрицательно.
2) \(\color{red}{\small\text{Неверно }}\)
Работу газа можно вычислить как площадь фигуры под графиком (только в координатах p-V!!!). По рисунку видно, что газ в процессе 3-4 совершает работу.
3) \(\color{green}{\small\text{Верно }}\)
Изменение внутренней энергии газа зависит от изменения температуры: \[\Delta U = \frac{3}{2}\nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Процесс 2-3 является изотермическим. Следовательно, изменение температуры равно нулю. Следовательно, и изменение внутренней энергии равно нулю.
4) \(\color{green}{\small\text{Верно }}\)
Работа внешних сил над газом в процессе 1-2 равна: \[A_{1-2} = - A'_{1-2}\] Работа газа \(A'_{1-2}\) зависит от изменения объема: \(A'_{1-2} = p\Delta V\). Процесс 1-2 является изохорным, поэтому работа газа равна нулю.
5) \(\color{red}{\small\text{Неверно }}\)
По графику в координатах \(p-V\) видно, что объем газа в состоянии 4 минимален.
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах \(p-V\), где \(p\) — давление газа, \(V\) — объем газа. Количество вещества газа остается неизменным.
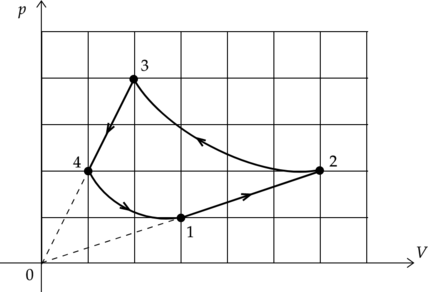
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) В процессе 2-3 газ получил из окружающей среды положительное количество теплоты.
2) Работа, совершенная над газом в процессе 3-4, в 1,5 раза меньше, чем работа, совершенная газом в процессе 1-2.
3) В процессе 1-2 внутренняя энергия газа увеличивалась.
4) Газ за цикл совершил положительную работу.
5) В процессах 1-2 и 3-4 количество теплоты, переданной системе, равно нулю.
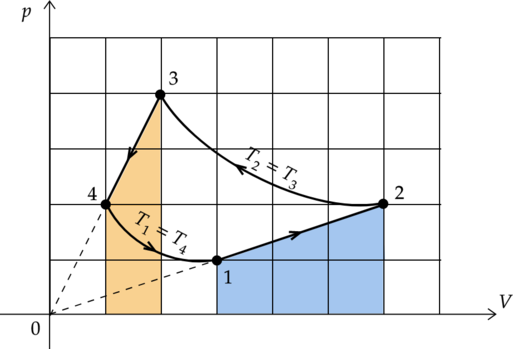
1) \(\color{red}{\small\text{Неверно }}\)
Процесс 2-3 является изотермическим. Запишем первый закон термодинамики для изотермического процесса: \[Q_{2-3} = A'_{2-3}\] Работа газа зависит от изменения его объема: \(A' = p\Delta V\) По графику видно, что в процессе 2-3 объем газа уменьшался. Следовательно, он совершил отрицательную работу \(A'_{2-3}\). Значит, количество теплоты \(Q_{2-3}\) также отрицательно, и газ не получил теплоту из окружающей среды, а отдал ее.
2) \(\color{green}{\small\text{Верно }}\)
Работу газа можно найти как площадь под графиком процесса (процессы 1-2 и 3-4 – как площадь трапеции). \[A'_{1-2} = S_{1-2} = \frac{2+4}{2}\cdot1 = 3\] \[A'_{3-4} = S_{3-4} = \frac{1+2}{2}\cdot3 = 4,5\] Найдем отношение этих работ: \[\displaystyle{\frac{A'_{3-4}}{A'_{1-2}} = \frac{4,5}{3} = 1,5}\]
3) \(\color{green}{\small\text{Верно }}\)
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U = \frac{3}{2} \nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
По графику видно, что изотерма \(T_2\) лежит ”выше”, чем изотерма \(T_1\): \(\Delta T = T_2 - T_1 > 0\). Следовательно, изменение внутренней энергии в процессе 1-2 положительно - она увеличилась.
4) \(\color{red}{\small\text{Неверно }}\)
Работа \(A_\text{ц}\), совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1. Так как объем газа уменьшается (направление цикла против часовой стрелки), то работа цикла отрицательна. 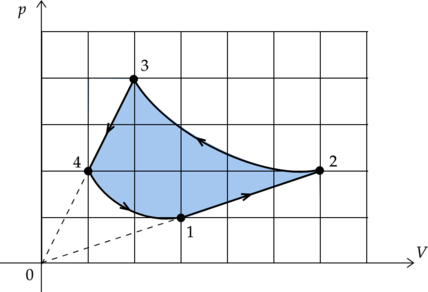
5) \(\color{red}{\small\text{Неверно }}\)
Процессы 1-2 и 3-4 не являются адиабатными. Следовательно, количество теплоты, переданной системе, в этих процессах не равно нулю.
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах \(p-V\), где \(p\) — давление газа, \(V\) — объем газа. Количество газа остается неизменным.

Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Процесс 5-6 является изотермическим.
2) В процессе 2-3 газ совершает положительную работу, причем его внутренняя энергия увеличивается.
3) Работа газа за цикл равна нулю.
4) В процессе 6-7 газ получает положительное количество теплоты.
5) Работа газа в процессе 4-5 минимальна по модулю.
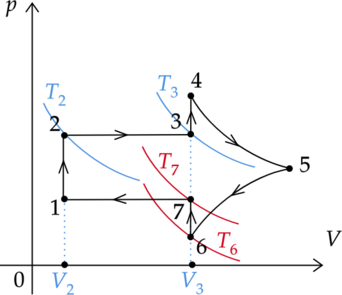
1) \(\color{red}{\small\text{Неверно }}\)
Процесс 5-6 не является изотермическим.
2) \(\color{green}{\small\text{Верно }}\)
Работа газа прямо пропорциональна изменению его объема и в процессе 2-3 она равна: \[A'_{2-3} = p_2\Delta V = p_2(V_3-V_2)\] Заметим, что \((V_3-V_2) > 0\). Следовательно, и изменение объема газа также больше нуля: \(\Delta V > 0\). Следовательно, газ в процессе 2-3 совершает положительную работу: \(A'_{2-3} > 0\).
Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U = \frac{3}{2}\nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Процесс 2-3 является изобарным. Следовательно, температура газа изменяется. Мысленно проведем на графике две изотермы: \(T_2\) и \(T_3\). Так как изотерма \(T_3\) лежит ”выше” изотермы \(T_2\), то \(T_3 > T_2\). Cледовательно, изменение температуры положительно: \(\Delta T = T_3 - T_2 > 0\). Следовательно, и изменение внутренней энергии \(\Delta U\) также положительно, поэтому внутренняя энергия газа в процессе 2-3 увеличивается.
3) \(\color{red}{\small\text{Неверно }}\)
Работа \(A_\text{ц}\), совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-5-6-7-1. Так как объем газа увеличивался (цикл направлен по часовой стрелке), то работа цикла положительна.
4) \(\color{green}{\small\text{Верно }}\)
Процесс 6-7 — изохорный (т.к. \(V_6 = V_7 = const\)). Запишем первый закон термодинамики для изохорного процесса: \[Q_{6-7} = \Delta U_{6-7}\] Изменение внутренней энергии газа зависит от изменения его температуры: \[\Delta U_{6-7} = \frac{3}{2}\nu R\Delta T,\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Мысленно проведем на графике две изотермы: \(T_6\) и \(T_7\). Так как изотерма \(T_6\) лежит ”ниже” изотермы \(T_7\), то \(T_6 < T_7\). Cледовательно, изменение температуры положительно: \(\Delta T = T_7 - T_6 > 0\). Следовательно, и изменение внутренней энергии \(\Delta U_{6-7}\) также положительно.
Так как изменение внутренней энергии газа положительно, то и количество теплоты \(Q_{6-7}\) также положительно. Значит, газ получает положительное количество теплоты.
5) \(\color{red}{\small\text{Неверно }}\)
Работу газа в процессе 4-5 можно найти как площадь под графиком этого процесса. По рисунку видно, что площадь под под графиком 4-5 не самая наименьшая (сравните ее с площадью под графиком процесса 5-6). Следовательно, и модуль работы газа, совершенной за этот процесс, не минимален. 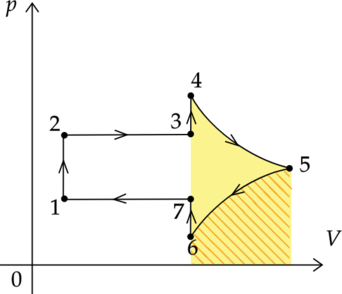
На \(pT\)-диаграмме отображена последовательность четырех процессов изменения состояния 2 моль идеального одноатомного газа.
 Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
Из приведенного ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
1) Газ за цикл совершает отрицательную работу.
2) Работа газа в процессе 1-2 максимальна по модулю.
3) В процессе 2-3 газ отдает положительное количество теплоты в окружающую среду.
4) Изменение внутренней энергии газа в процессе 1-2 в три раза больше, чем в состоянии 4-1.
5) В состоянии 3 объем газа максимален.
Для более удобной работы перестроим график из координат \(p-T\) в координаты \(p-V\):
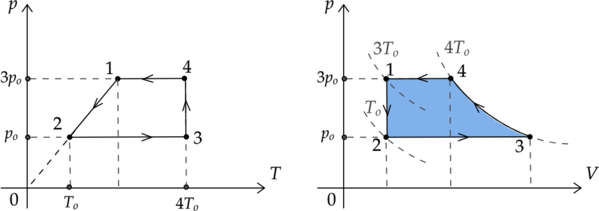
1) \(\color{green}{\small\text{Верно }}\)
Работа \(A_\text{ц}\), совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1. Так как объем газа уменьшается (направление цикла против часовой стрелки), то работа цикла отрицательна.
2) \(\color{red}{\small\text{Неверно }}\)
Работа газа зависит от изменения объема: \[A' = p\Delta V\] По графику (в \(pV\)-координатах это очевидно, в \(pT\)-координатах можно исходить из того, что точки 1 и 2 лежат на одной изохоре) видно, что в процессе 1-2 объем газа остается неизменным. Следовательно, газ не совершает работу.
3) \(\color{red}{\small\text{Неверно }}\)
Процесс 2-3 — изобарный (т.к. \(p_2 = p_3 = const\)). Запишем первый закон термодинамики для изобарного процесса: \[Q_{2-3} = A'_{2-3} + \Delta U_{2-3}\]
Работа газа зависит от изменения объема газа: \[A'_{2-3} = p \Delta V\] По рисунку видно, что \(V_3 > V_2\). Cледовательно, изменение объема положительно: \(\Delta V = V_3 - V_2 > 0\). Значит, газ совершил положительную работу.
Изменение внутренней энергии газа зависит от температуры: \[\displaystyle{\Delta U = \frac{3}{2} \nu R\Delta T},\] где \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная.
Мысленно проведем две изотермы: \(T_2\) и \(T_3\). Так как изотерма \(T_3\) лежит ”выше” изотермы \(T_2\), то \(T_3 > T_2\). Cледовательно, изменение температуры положительно: \(\Delta T = T_3 - T_2 > 0\). Следовательно, и изменение внутренней энергии \(\Delta U_{2-3}\) также положительно.
Так как изменение внутренней энергии газа и его работа положительны, то и количество теплоты \(Q_{3-4}\) также положительно, поэтому газ не отдает теплоту, а получает ее.
4) \(\color{red}{\small\text{Неверно }}\)
Найдем отношение изменений внутренних энергий \(\Delta U_{1-2}\) и \(\Delta U_{4-1}\). \[\displaystyle{\frac{\Delta U_{1-2}}{\Delta U_{4-1}} = \frac{\frac{3}{2}\nu R(T_2-T_1)}{\frac{3}{2}\nu R(T_1-T_4)}}\] Температуру \(T_1\) можно найти из закона Гей-Люссака (т.к. процесс 1-2 изохорный): \[\displaystyle{\frac{p_1}{T_1} = \frac{p_2}{T_2} \Rightarrow T_1 = \frac{p_1T_2}{p_2} = \frac{3p_oT_o}{p_o} = 3T_o}\] Подставим это значение в предыдущую формулу: \[\displaystyle{\frac{\Delta U_{1-2}}{\Delta U_{4-1}} = \frac{\frac{3}{2}\nu R(T_o-3T_o)}{\frac{3}{2}\nu R(3T_o-4T_o)} = \frac{2T_o}{T_o} = 2}\]
5) \(\color{green}{\small\text{Верно }}\)
Исходя из графика в \(pV\)-координатах, очевидно, что утверждение верно.
На графике в \(pT\)-координатах можно провести изохоры и убедиться, что изохора \(V_3\) лежит ”ниже” всех остальных. Следовательно, объем газа в состоянии 3 максимален.



