Термодинамика (страница 2)

В вертикальном цилиндре, закрытом лёгким поршнем, находится бензол \((C_6H_6)\) при температуре кипения \(t =80^\circ C\). При сообщении бензолу некоторого количества теплоты часть его превращается в пар, который при изобарном расширении совершает работу, поднимая поршень. Удельная теплота парообразования бензола \( L = 396\cdot 10^3 \)Дж/кг, а его молярная масса \(M =78\cdot 10^{-3}\) – кг/моль. Какая часть подводимого к бензолу количества теплоты идёт на увеличение внутренней энергии системы? Объёмом жидкого бензола и трением между поршнем и цилиндром пренебречь. “Досрочная волна 2020 вариант 1”
По первому закону термодинамики \[Q=\Delta U+A,\quad (1)\] \(Q\) – количество теплоты, полученное системой, \(\Delta U\) – изменение внутренней энергии, \(A\) – работа газа.
А количество теплоты, полученное системой равно \[Q=Lm,\quad (2)\] где \(m\) – масса образовавшегося пара.
Так как процесс испарения прошел не до конца, то данный процесс изотермический, а значит работа газа будет совершаться за счет изменения массы пара \[A=\dfrac{m}{M}RT,\quad (3)\] где \(T\) – температура газа в Кельвинах.
Объединим (1), (2) и (3) и найдем отношение \(\dfrac{\Delta U}{Q}\) \[\dfrac{\Delta U}{Q}=\dfrac{Q-A}{Q}=1-\dfrac{\dfrac{m}{M}RT}{Lm}=\dfrac{RT}{LM}=\dfrac{8,31 \text{ Дж/(К$\cdot$моль)}\cdot (273+80)\text{ К}}{396\cdot 10^3\text{ Дж/кг}\cdot 78\cdot 10^{-3}\text{ кг/моль}}\approx 90,5 \%\]
Цикл тепловой машины, рабочим веществом которой является \(\nu\) молей идеального одноатомного газа, состоит из изотермического расширения, изохорного охлаждения и адиабатического сжатия. Работа, совершённая газом в изотермическом процессе, равна \(A\), а КПД тепловой машины равен \(\eta\). Максимальная температура в этом цикле равна \(T_o\). Определите минимальную температуру \(T\) в этом циклическом процессе.
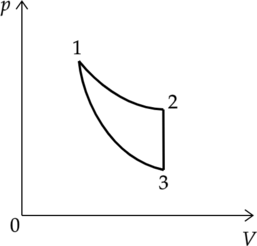
Процессы:
1-2 — изотермический
2-3 — изохорный
3-1 — адиабатический
КПД тепловой машины равен: \[\; \; \; \; \eta = \dfrac{A_\text{ц}}{Q_\text{н}} \; \; \; \; (1)\] где \(A_\text{ц}\) — работа, совершенная газом за цикл, \(Q_\text{н}\) — количество теплоты, полученное газом от нагревателя.
Работа газа за цикл есть сумма работ газа в каждом процессе: \[A_\text{ц} = A_{1-2} + A_{2-3} + A_{3-1}\] Так как в процессе 2-3 объем газа постоянен, то его работа равна нулю.
Тогда работа газа за цикл равна: \[\; \; \; \; A_\text{ц} = A_{1-2} + A_{3-1} \; \; \; \; (2)\] Далее необходимо найти количество теплоты \(Q_\text{н}\), полученное газом от нагревателя.
Для этого запишем первое начало термодинамики для каждого процесса.
Процесс 1-2: \[Q_{1-2} = A_{1-2} + \Delta U_{1-2}\] Так как процесс 1-2 изотермический, то изменение внутренней энергии газа \(\Delta U_{1-2}\) равно нулю.
Объем газа увеличивается, следовательно, газ совершает положительную работу.
Отсюда получаем, что: \[Q_{1-2} = A_{1-2} > 0 \; \; \; \Rightarrow \; \; \; \; Q_{1-2} > 0\] Процесс 2-3: \[Q_{2-3} = A_{2-3} + \Delta U_{2-3}\] Так как процесс 2-3 изохорный, то работа газа \(A_{2-3}\) равна нулю.
Давление газа уменьшается, следовательно, его температура также уменьшается (для изохорного процесса \(p \sim T\)).
Следовательно, изменение внутренней энергии газа отрицательно.
Отсюда получаем, что: \[Q_{2-3} = \Delta U_{2-3} < 0 \; \; \; \Rightarrow \; \; \; \; Q_{2-3} < 0\] Процесс 3-1:
Так как процесс 3-1 адиабатный, то \(Q_{3-1} = 0\): \[\; \; \; \; Q_{3-1} = A_{3-1} + \Delta U_{3-1} \; \; \; \Rightarrow \; \; \; \; A_{3-1} = - \Delta U_{3-1} \; \; \; \; (3)\] Таким образом, количество теплоты, полученное газом от нагревателя равно: \[Q_\text{н} = Q_{1-2}\] \[\; \; \; \; Q_\text{н} = A_{1-2} \; \; \; \; (4)\] Подставим (2), (4) в (1): \[\eta = \dfrac{A_{1-2} + A_{3-1}}{A_{1-2}}\] \[\; \; \; \; \eta = 1 + \dfrac{A_{3-1}}{A_{1-2}} \; \; \; \; (5)\] Подставим (3) в (5): \[\; \; \; \; \eta = 1 - \dfrac{\Delta U_{3-1}}{A_{1-2}} \; \; \; \; (6)\] Изменение внутренней энергии газа в процессе 3-1 равно: \[\; \; \; \; \Delta U_{2-3} = \dfrac{3}{2}\nu R(T_1 - T_3) \; \; \; \; (7)\] где \(R\) — универсальная газовая постоянная.
Подставим (7) в (6) и выразим искомую температуру: \[\eta = 1 - \dfrac{\dfrac{3}{2}\nu R(T_1 - T_3)}{A_{1-2}}\] \[T_3 = T_1 - \dfrac{2}{3\nu R} (1 - \eta)A_{1-2}\] Температура \(T_1\) является максимальной в этом цикле, так как точка 1 на графике принадлежит изотерме 1-2, которая лежит выше, чем изотерма, проведенная через точку 3: \(T_1 = T_o\).
Следовательно, температура \(T_3\) является минимальной: \(T_3 = T\).
Работа \(A_{1-2}\) совершена газом в изотермическом процессе: \(A_{1-2} = A\).
Таким образом, искомая температура равна: \[T = T_o - \dfrac{2}{3\nu R} (1 - \eta)A\]
В гладком вертикальном цилиндре под подвижным поршнем массой \(M\) и площадью \(S\) находится идеальный одноатомный газ. Поршень в равновесии располагается на высоте \(h\) над дном цилиндра. После сообщения газу количества теплоты \(Q\) поршень приподнялся, а газ нагрелся. Найдите, на какой высоте \(H\) над дном цилиндра находится поршень. Давление в окружающей цилиндр среде равно \(p_o\).
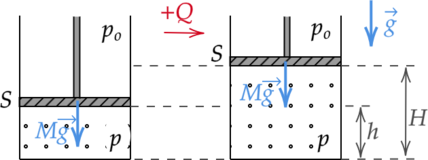
Рассматриваемый процесс — изобарный (так как поршень подвижный и количество вещества газа не изменяется).
Запишем первое начало термодинамики для изобарного процесса: \[\; \; \; \; Q = A+\Delta U \; \; \; \; (1)\] где \(A\) — работа газа, \(\Delta U\) — изменение внутренней энергии газа.
Работа газа и изменение его внутренней энергии равны: \[\; \; \; \; A = p\Delta V \; \; \; \; (2) \; \; \; \; \; \; \; \; \; \; \; \Delta U = \dfrac{i}{2}\nu R\Delta T \; \; \; \; (3)\] где \(p\) — давление газа под поршнем, \(\Delta V\) — изменение объема газа, \(i\) — число степеней свободы (для одноатомного газа \(i = 3\)), \(\nu\) — количество вещества газа, \(R\) — универсальная газовая постоянная, \(\Delta T\) — изменение температуры газа.
Подставим (2), (3) в (1): \[Q = p\Delta V + \dfrac{3}{2}\nu R\Delta T\] Для изобарного процесса справедливо равенство: \(p\Delta V = \nu R\Delta T\).
Тогда уравнение (4) примет вид: \[\; \; \; \; Q = p\Delta V + \dfrac{3}{2}p\Delta V = \dfrac{5}{2}p\Delta V \; \; \; \; (5)\] Давление внутри сосуда складывается из атмосферного давления и давления, оказываемого поршнем (так как у него есть масса): \[\; \; \; \; p = p_o + \dfrac{Mg}{S} \; \; \; \; (6)\] где \(g\) — ускорение свободного падения.
Изменение объема, занимаемого газом, после сообщения теплоты равно: \[\; \; \; \; \Delta V = (H-h)S \; \; \; \; (7)\] Подставим (6), (7) в (5) и выразим высоту, на которой будет находиться поршень над дном цилиндра: \[Q = \dfrac{5}{2}\left( p_o + \dfrac{Mg}{S} \right) (H-h)S\] \[H=h+\dfrac{2Q}{5(p_oS+Mg)}\]
Два одинаковых теплоизолированных сосуда соединены короткой трубкой с краном. В первом сосуде находится \(\nu_1\) =3 моль гелия при температуре \(T_1 = 350\) К, во втором \(\nu_2\) = 2 моль аргона при температуре \(T_2 = 400\) К. Кран открывают. В установившемся равновесном состоянии давление в сосудах становится \(p = 6 \) кПа. Определите объём \(V \) одного сосуда. Объёмом трубки пренебречь. Ответ дайте в м\(^3\) и округлите до тысячных.
Так как сосуды теплоизолированные, а газ не совершает работы, то изменение внутренней энергии равно 0, то есть \[U_1+U_2=U\] где \(U_1\) – внутренняя энергия первого сосуда, \(U_2\) – внутренняя энергия второго сосуда, \(U\) – внутренняя энергия сосудов после открытия краника.
Или \[\dfrac{3}{2}\nu_1R T_1+\dfrac{3}{2}\nu_2RT_2=\dfrac{3}{2}\left(\nu_1+\nu_2\right)RT\] Отсюда установившаяся температура \[T=\dfrac{\nu_1T_1+\nu_2T_2}{\nu_1+\nu_2}\] По закону Клапейрона – Менделеева \[p2V=\left(\nu_1+\nu_2\right)RT\] Отсюда объем одного сосуда \[V=\dfrac{\left( \nu_1T_1+\nu_2T_2\right)R}{2p}=\dfrac{\left( 3\text{ моль} \cdot 350\text{ К}+2\text{ моль} \cdot 400\text{ К}\right)\cdot 8,31 \text{ Дж/(моль$\cdot$ К)}}{2\cdot 6\cdot 10^3 \text{ Па}}\approx 1,28\text{ м$^3$ }\]
1 моль идеального одноатомного газа сначала изотермически расширили. Затем изохорно нагрели, при этом его давление возросло в 3 раза (см. рисунок). Какое количество теплоты получил газ на участке 2–3, если \(T_1=100\) К? Ответ дайте в Дж.
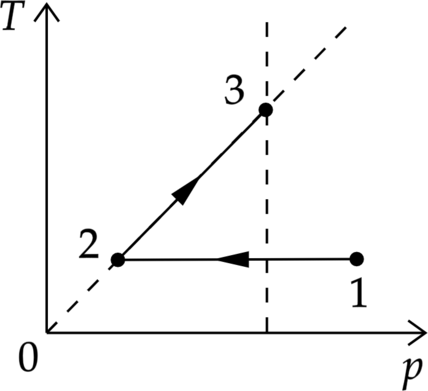
1. Воспользуемся первым законом термодинамики \[Q=\Delta U+A,\] где \(Q\) – количество теплоты, полученное системой, \(\Delta U\) – изменение внутренней энергии системы, \(A\) – работа газа.
Так как процесс изохорный, то работа газа равна 0. Распишем изменение внутренней энергии и получим \[Q=\dfrac{3}{2}\nu R \Delta T=\dfrac{3}{2}\nu R \left(T_3-T_2\right)\] 2. Воспользуемся законом Шарля \[\dfrac{p_2}{T_2}=\dfrac{p_3}{T_3} \Rightarrow T_3=\dfrac{p_3 T_2}{p_2}=3T_2\] 3. По условию процесс 1–2 изотермический, значит \[T_1=T_2\] Следовательно, первый закон термодинамики выглядит \[Q=\dfrac{3}{2}\nu R \left(3T_1-T_1\right)=3\nu R T_1= 3\cdot 1 \text{ моль} \cdot 8,31 \text{ Дж/(моль $\cdot$ К)}\cdot 100\text{ К}=2493\text{ Дж}\]
Один моль одноатомного идеального газа совершает процесс 1–2–3, график которого показан на рисунке в координатах T–V, Известно, что в процессе 1–2 газ совершил работу 3 кДж, а в процессе 2–3 объём газа V увеличился в 2 раза. Какое количество теплоты было сообщено газу в процессе 1–2–3, если его температура Т в состоянии 3 равна 600 К? Ответ дайте в Дж.
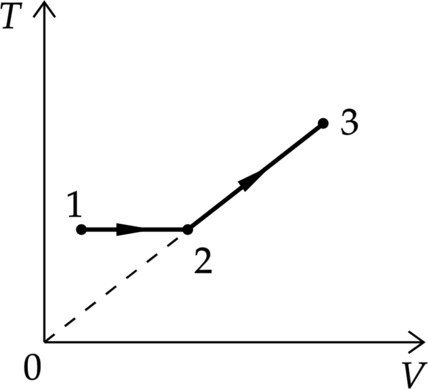
1.Проанализируем процессы
1–2 Процесс изотермический, по закон Бойля-Мариотта \[p_1 V_1=p_2V_2\] Значит возрастает объем и давление.
2–3 Температура увеличивается линейно объему, следовательно, процесс изобарный.
2. Количество теплоты, полученное в процессе 1–2–3, равно сумме количеств теплоты, полученных в процессах 1–2 и 2–3. \[Q_{123}=Q_{12}+Q_{23}\] 3. По первому закону термодинамики \[Q=\Delta U +A,\] где \(Q\) – количество теплоты, полученное системой, \(\Delta U\) – изменение внутренней энергии системы, \(A\) – работа газа.
Значит в процессе 1–2 изменение внутренней энергии равно 0, а количество теплоты \[Q_{12}=A_{12}=3 \text{ кДж}\] В процессе 2–3 по условию объем возрос в 2 раза, значит по закону Гей-Люссака \[\dfrac{V_2}{T_2}=\dfrac{V_3}{T_3}\Rightarrow T_2=\dfrac{V_2 T_3}{V_3}= \dfrac{600\text{ К}}{2}=300\text{ К}\] По закону Клапейрона–Менделеева \[pV=\nu R T\] Значит количество теплоты, полученное в процессе 2–3 равно \[Q_{23}=\dfrac{3}{2}\nu R \left(T_3-T_2\right)+p\left( V_3-V_2\right)=\dfrac{3}{2}\nu R \left(T_3-T_2\right)+\nu R \left(T_3-T_2\right)=\dfrac{5}{2}\nu R \left(T_3-T_2\right)\] \[Q_{23}=\dfrac{5}{2}\cdot 1 \text{ моль} \cdot 8,31 \text{ Дж/(моль $\cdot$ К)}\left( 600 \text{ К}- 300\text{ К}\right)= 6232,5 \text{ Дж}\] А общее количество теплоты \[Q=Q_{12}+Q_{23}=6232,5 \text{ Дж}+ 3000\text{ Дж}=9232,5 \text{ Дж}\]
На рисунке показан циклический процесс постоянное количество одноатомного газа. Работу, которую совершают внешние силы при переходе газа из состояния 2 в состояние 3, равна 5 кДж. Какое количество теплоты газ отдаёт за цикл холодильнику? Ответ дайте в кДж 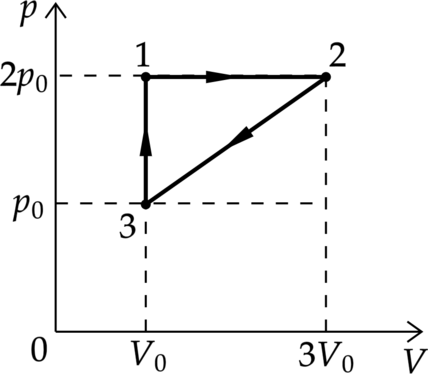
Работа внешних сил в процессе 2–3 равна площади под графиком. \[A_{23}=\dfrac{p_0+2p_0}{2}\left(3V_0-V_0\right)=3p_0V_0\] \(p\) – давление, \(V\) – объем газа, \(\nu\) – количество вещества, \(T\) – температура газа в Кельвинах.
Воспользуемся первым законом термодинамики \[|Q_{\text{ хол}}|=|Q_{23}|=\Delta U_{23}+A_{32}=\dfrac{3}{2}\left( \nu R T_2 -\nu R T_3\right)+ 3p_0V_0\quad (1)\] Также по уравнению Клапейрона – Менделеева \[p_2V_2=\nu R T_2= 2p_0 \cdot 3V_0 =6p_0V_0 \quad (2)\] \[p_2V_2=\nu R T_3=p_0V_0 \quad (3)\] Подставим в (1) формулы (2) и (3) \[|Q_{\text{ хол}}|=\dfrac{3}{2}\left(6p_0V_0-p_0V_0\right)+3p_0V_0= \dfrac{21}{2}p_0V_0=\dfrac{7}{2}A_{23}=3,5 \cdot 5\text{ кДж} =17,5\text{ кДж}\]



