04 Изопроцессы
Ошибка.
Попробуйте повторить позже
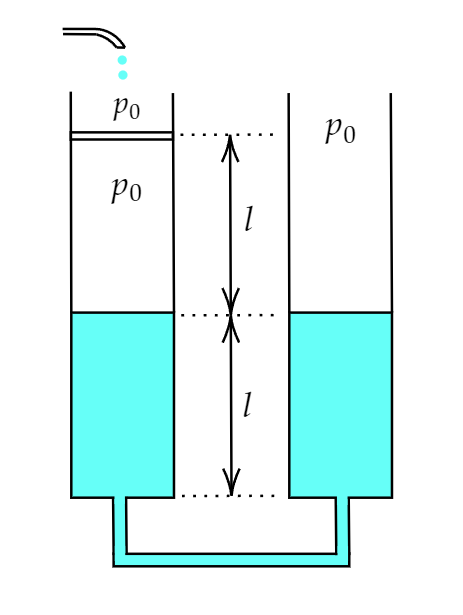
В двух сообщающихся одинаковых вертикальных цилиндрических сосудах находится жидкость
плотности . Первоначальный уровень жидкости в сосудах
от дна (рис.). Сосуды
соединены через отверстия в середине дна маленькой трубочкой пренебрежимо малого объёма. В
левом сосуде на высоте
от дна находится невесомый поршень, который может свободно
перемещаться без трения о стенки. Под поршнем находится воздух при атмосферном давлении
. С момента времени
в левый сосуд в пространство над поршнем начинает
поступать та же жидкость, причём скорость прироста уровня воды над поршнем составляет
.
1) С какой скоростью движется поверхность жидкости в правом сосуде в начале процесса?
2) С какой скоростью и куда движется поверхность жидкости над поршнем в начале процесса?
3) На какой высоте от дна сосуда будет находиться поверхность жидкости над поршнем: а) через
? б) через
?
Температуру в сосудах можно считать постоянной. Жидкость из сосудов не выливается.
Источники:
1) Пусть через малое время после начала поступления жидкости на поршень высота столба
жидкости в правом цилиндре возросла на
. Из условия гидростатического равновесия в
сосудах
Из этого уравнения находим скорость поднятия жидкости в правой части сосуда в начале процесса:
2) Пусть - площадь поршня. Из закона Бойля-Мариотта
найдем высоту столба воздуха в левом сосуде:
Здесь - время поступления жидкости в левый сосуд. Тогда поверхность жидкости над поршнем
находится на высоте
от дна сосуда.
При малых высота
то есть в начале процесса скорость изменения высоты поверхности жидкости близка к
нулю.
За) Из формулы (1) следует. Что при с искомая высота
см.
3б) Формальная подстановка даёт, что через с в левом цилиндре под поршнем уровень
жидкости опустится на
. Но, это больше
. Следовательно, к этому времени вся вода
из под поршня перетечет в правую часть, а воздух под поршнем "пробулькнет"и поршень
опустится на дно. Тогда высота поверхности жидкости над поршнем окажется
см.
(Официальное решение ВсОШ)
Ошибка.
Попробуйте повторить позже
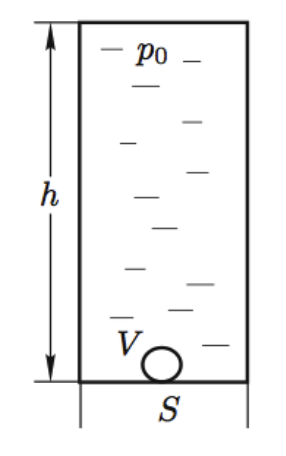
В высоком закрытом вертикально расположенном цилиндрическом сосуде сечением и высотой
находится вода, занимающая весь объём сосуда, кроме маленького пузырька воздуха объёмом
,
образовавшегося у дна (рис.). Давление воды в верхней части сосуда равно атмосферному давлению
.
Определите, каким будет давление воды в верхней части сосуда после того, как пузырёк поднимется
вверх. Процесс считать изотермическим. Модуль всестороннего сжатия жидкости равен
.
Рассмотрите предельные переходы:
1) ,
2) (сильно сжимаемая жидкость),
3) (несжимаемая жидкость).
Найдите численное решение задачи для случая ,
,
,
,
плотность воды
,
. Примечание. Модуль всестороннего сжатия жидкости
определяется соотношением
где — изменение давления,
— относительное изменение объёма жидкости.
Источники:
Давление воздуха в пузырьке у дна сосуда . Пусть после подъёма пузырька вверх
давление воздуха стало равным
, а объём
.
Поскольку , то
.
Так как процесс изотермический, . Обозначая отношение
через
, получим:
Решая квадратное уравнение, получаем:
Давление в верхней части сосуда
(Мы учли, что объём пузырька не может стать меньше нуля, и поэтому одно из решений не
подходит.) Числовой расчёт даёт для значение
Па.
Таким образом, при подъёме пузырька давление во всём сосуде возрастёт на величину
Па. При этом давление в пузырьке изменится на
Па. Следовательно,
. В предельных случаях расчёт даёт следующие результаты:
1. Из следует
.
2. Из следует
.
3. Из следует
.
Примечание. Так как относительное изменение давления в пузырьке при его подъёме достаточно мало,
можно было воспользоваться приближённой формулой, связывающей изменения давления и объёма
воздуха в пузырьке при его подъёме: . Из этой формулы следует
.
Формула для
приобретает следующий приближённый вид:
Предельные переходы дают те же результаты, что и при точном решении. Приближённое решение
будет рассматриваться как полное решение задачи при условии обоснованности его примени мости
.
(Официальное решение ВсОШ)
Ошибка.
Попробуйте повторить позже
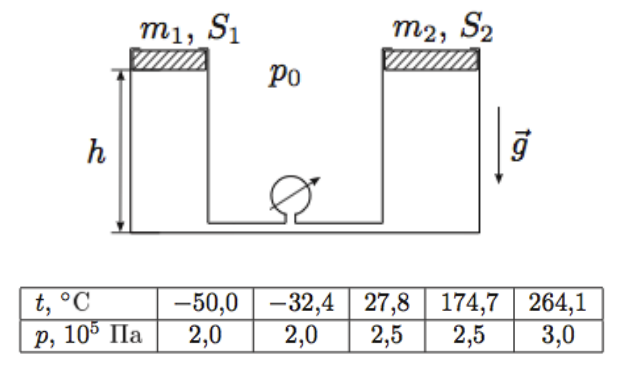
Два вертикальных цилиндрических сосуда соединены в нижней части трубкой с манометром
пренебрежимо малого объёма (рис.). Внутри цилиндров установлены поршни, в верхней части
цилиндров — упоры, ограничивающие подъём поршней. Расстояния от нижней части поршней до дна
цилиндров при верхнем расположении поршней одинаковы и равны . Под поршнями находится
один моль идеального газа, атмосферное давление
. Поршни могут перемещаться в
цилиндрах без трения. В таблице представлены результаты измерений давления в цилиндрах при пяти
различных значениях температуры газа. Определите массы обоих поршней
,
и площади сечения
цилиндров
,
.
Источники:
Теоретический вид зависимости давления от температуры для данной системы представлен на рисунке.
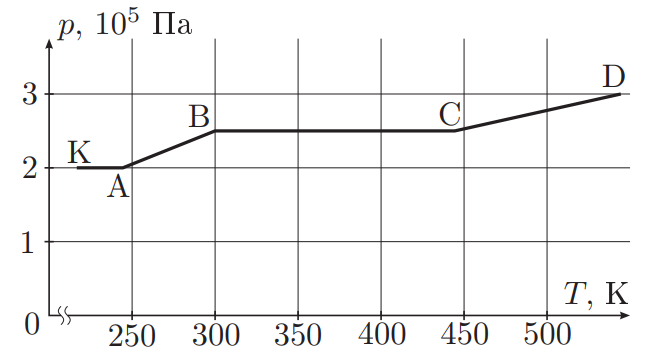
Давление на участке КА:
где меньшая из двух величин
и
В дальнейшем для определённости будем
считать меньшей
. На этом участке в цилиндре площади
протекает изобарический процесс до
момента поднятия поршня до упора (точка А на графике).
При дальнейшем увеличении температуры объём газа не меняется, а давление растёт вплоть до момента начала движения второго поршня (точка В). На участке AB:
В точке В давление
При дальнейшем росте температуры давление не меняется до момента, когда второй поршень до стигает верхнего положения (точка С).
Далее снова протекает изохорный процесс при объёме , так что:
Заметим, что данные таблицы таковы, что
где - давление и температура в Кельвинах в соответствующих ячейках таблицы. Значит,
параметры во второй, третьей и четвёртой ячейках таблицы соответствуют точкам
, C. Тогда для
участка AB:
Массу найдём из уравнения:
Аналогично:
Ошибка.
Попробуйте повторить позже
Гелий из состояния с температурой расширяется в процессе
(
— давление,
— объём газа) с постоянной теплоёмкостью
. От газа отвели количество теплоты
, и
конечный объём газа стал вдвое больше начального.
1) Определить конечную температуру гелия.
2) Определить теплоёмкость .
Источники:
1) Найдем конечное давление газа
Так как , то
Воспользуемся уравнением Клапейрона–Менделеева
Для
Для
2) Теплоемкость можно найти по формуле:
Ошибка.
Попробуйте повторить позже
Моль гелия, расширяясь в процессе 1–2 (см. рисунок), где его давление меняется прямо
пропорционально объёму
, совершает работу
. Из состояния 2 гелий расширяется в процессе 2–3, в
котором его теплоёмкость
остаётся постоянной и равной
(
– газовая постоянная).
Какую работу
совершит гелий в процессе 2–3, если его температура в состоянии 3 равна
температуре в состоянии 1?
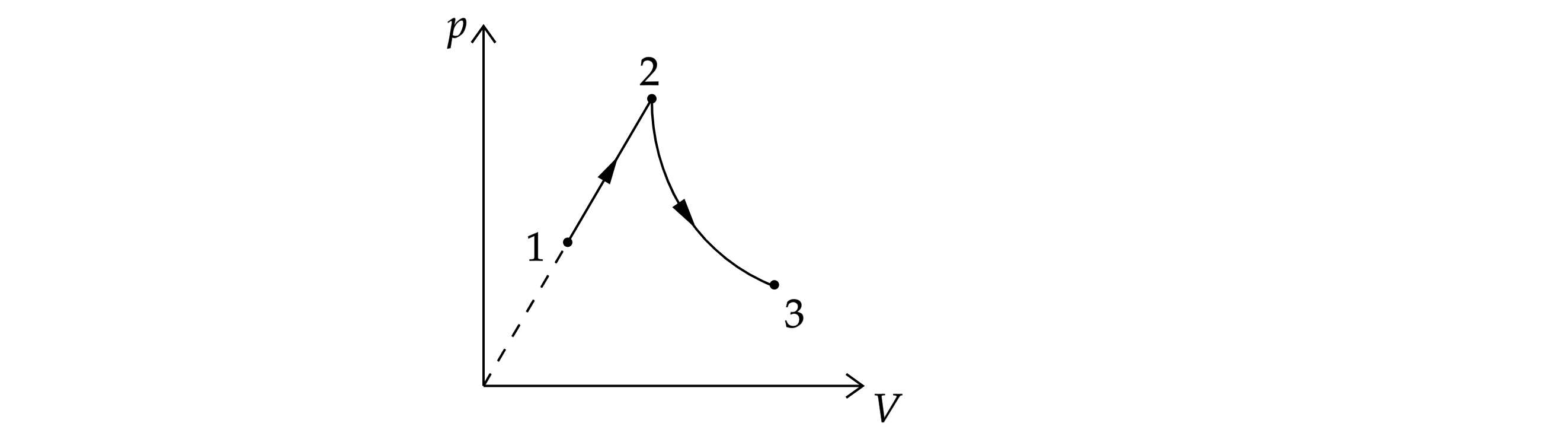
Источники:
Так как в процессе 1–2 давление зависит линейно от объема, то
Тогда работа газа в этом процессе равна
Или с учетом уравнения Клапейрона–Менделеева
Запишем первое начало термодинамики
Откуда , с учетом, что
и
Ошибка.
Попробуйте повторить позже
В двух теплоизолированных сосудах с объёмами и
находятся одинаковые газы при давлениях
и
и температурах
и
. Найдите температуру, которая установится в сосудах после
смешивания газов.
Источники:
Пусть и
– количество вещества в первом и во втором отсеках.
Запишем закон сохранения энергии
По уравнению Клайперона–Менделеева:
Откуда
Ошибка.
Попробуйте повторить позже
Теплоизолированный цилиндр объемом разделен на две части перегородкой. В одной части
находится водород в количестве
при температуре
, а в другой — азот в количестве
при
температуре
и другом давлении. Перегородка прорывается.
1. Какая температура , установится в смеси?
2. Найти давление в смеси.
(«Физтех», 2019, 10)
Источники:
1) После прорыва перегородки азот и водород занимают весь объем сосуда, образуя смесь двух газов. Внутренняя энергия смеси по закону сохранения энергии будет складываться из начальных внутренних энергий азота и водорода:
Количество вещества смеси также будет складываться из количества вещества азота и водорода:
Распишем внутренние энергии и выразим температуру смеси газов:
2) Запишем уравнение Менделеева-Клапейрона для смеси газов и выразим из него давление смеси:
Ошибка.
Попробуйте повторить позже
В вертикальном цилиндрическом сосуде под массивным поршнем находится одноатомный идеальный газ
при температуре , при этом поршень находится в равновесии. Температуру газа в сосуде
мгновенно увеличивают в два раза. Какая температура установится в сосуде после того, как
поршень перестанет двигаться? Теплоёмкостью поршня и сосуда пренебречь, теплопотери
отсутствуют.
(«Росатом», 2012, 10)
Источники:
Газ совершает работу по подъему поршня за счет своей внутренней энергии. Будем считать, что нагрев произошел настолько быстро, что поршень не успел за это время сместиться и набрать заметную скорость. Внутренняя энергия газа после нагрева составляет
Пусть поршень, в конце концов, поднялся на высоту над начальным положением
. Обозначив
конечную температуру
, запишем уравнение Менделеева-Клапейрона для газа до нагрева и после
установления равновесия, с учётом условия равновесия поршня
:
где – масса и
– площадь поршня. Теперь запишем закон сохранения энергии:
Решая эту систему уравнений, получим
Ошибка.
Попробуйте повторить позже
В процессе расширения к одноатомному идеальному газу было подведено количество теплоты, в 4 раза превышающее величину его внутренней энергии в начальном состоянии. Во сколько раз увеличился объём газа, если в процессе расширения он изменялся прямо пропорционально давлению? Под внутренней энергией газа понимается сумма кинетических энергий всех молекул.
Источники:
Пусть и
– начальная и конечная внутренняя энергии газа. Запишем первое начало
термодинамики
Пусть объем в процессе возрастает в раз, тогда давление тоже возрастает в
раз. Запишем
также уравнение Менделеева-Клапейрона
Откуда следует, что
Распишем первое уравнение
Тогда объем увеличится в 2 раза.
Ошибка.
Попробуйте повторить позже
Газообразный гелий из начального состояния 1 сжимают в изобарическом процессе 1–2, а затем газ
продолжают сжимать в адиабатическом процессе 2–3. Температуры в состояниях 1 и 3 равны. Найдите
работу, совершённую над газом в адиабатическом процессе, если в изобарическом процессе от газа
пришлось отвести тепла.
(«Физтех», 2010)
Источники:
Так как температуры в состояниях 1 и 3 равны, то
Запишем первый закон термодинамики для процесса 1–2
где – изменение внутренней энергии,
– работа газа.
Пусть работа над газом в процессе 2–3 равна . Для процесса 2–3 первый закон термодинамики
запишется в виде
Ошибка.
Попробуйте повторить позже
Тепловой двигатель работает по циклу, состоящему из изохоры 1–2, участка 2–3 линейной
зависимости давления от объёма и изобары 3–1 (см. рисунок; координаты точек 1, 2 и 3 указаны).
Рабочим веществом служит одноатомный идеальный газ. Вычислите КПД этого двигателя.
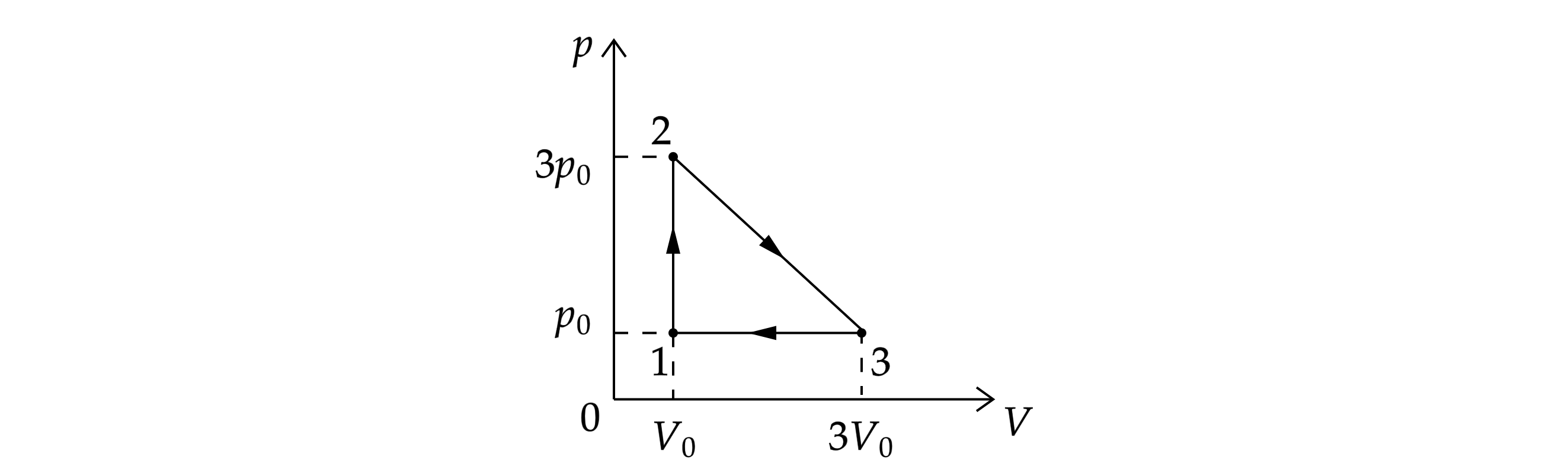
Работа газа за цикл равна площади треугольника
Найдем количество теплоты, полученное газом, в каждом процессе
Найдем критическую точку, до которой еще подводится тепло, для этого введем уравнение прямой
Тогда или в приращениях
Тогда количество теплоты
Чтобы было положительным, должно быть выполнено условие
. Тогда
давление равно
. Тогда количество теплоты получено на участке
Откуда КПД


